「IEC62304 × 認証支援 × セキュリティ」医療機器の安心をリベルワークスが支えます。
- 医療機器を世に出したいが、セキュリティに詳しいチームがいない
- 薬機・PMDA対応の書類とセキュリティ要件をまとめて見てくれる人がいない
- SaMDとして世に出したいが、セキュリティ文書の通し方が分からない
▶ そうした課題を、現場と認証両方に通じたエンジニアチームがサポートします

【1】 開発支援 ×セキュリティ
- JIS T 2304(IEC62304) 準拠の開発体制で、セキュリティ対策も実施します。JIS T 81001-5-1 に準拠!
- 医療機器を世に出したいが、セキュリティに詳しいチームがない
- 薬機・PMDA対応の書類とセキュリティ要件をまとめて見てくれる人がいない
- SaMDとして世に出したいが、セキュリティ文書の通し方が分からない
【2】SBOM・脆弱性管理
製品のセキュリティリスクを見える化!対応検討をお任せください!
- SBOM作成・運用支援
- 弱性評価・ドキュメント作成
- 脆弱性情報の継続モニタリングと通知
【3】認証支援・書類作成
- SaMD向けセキュリティ文書整備
- PMDA向け申請書類レビュー&実装支援
- 海外認証(FDA premarket guidance, MDR等)でのセキュリティ要件への対応
医療機器のサイバーセキュリティ対策の義務化
令和5年の厚生労働省通知(*1)により、医療機器の販売元(**)に対して、サイバーセキュリティの対策を行うことが義務化されました。経過措置を経て、令和6年4月1日以降に販売する医療機器にはすべてセキュリティ対策を計画時から含めことが求められました。
* 令和 5年 3月 31日付、厚生労働省告示第67号、、運用通知:医療機器の基本要件基準第12条第3項の適用について通知(薬生機審発0331第8号) 本告示の公示に伴い、3月31日付、手引書(第2版):医療機器のサイバーセキュリティ導入に関する手引書の改訂について(令和5年3月31日付 薬生機審発0331第11 号/薬生安発0331第4号)が発出されました。
** 医療機器の製造販売業者・製造業者・開発者
支援体制とプロセス
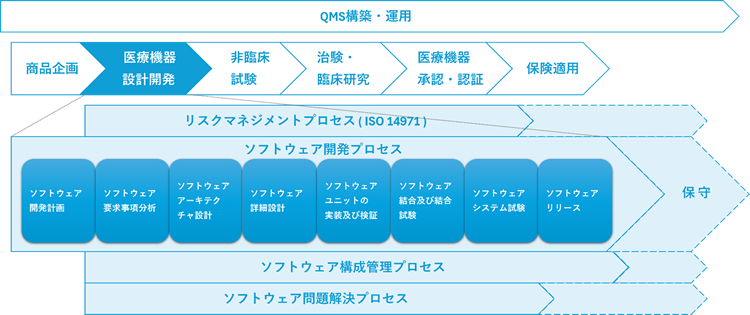
- 顧客チームとの並走型支援(要件定義〜運用保守)
- 既存ソフトをお預かりして、認証取得まで対応
- GAP分析 → セキュリティ設計 → ドキュメント整備 → 試験実施 → 認証立会
